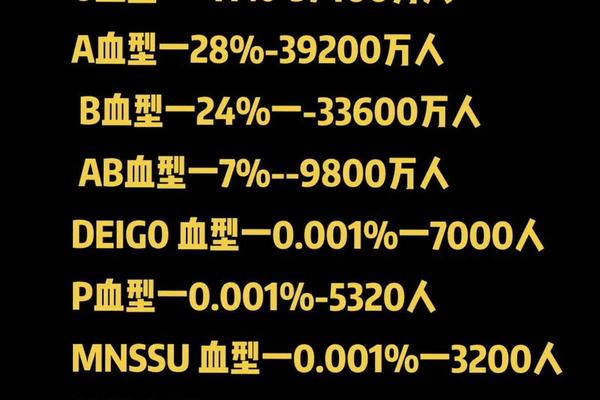
当我们谈论“熊猫血”时,多数人首先联想到的是Rh阴性血型。网络上常出现将AB型血直接等同于“熊猫血”的误解。实际上,“熊猫血”的稀有性源于双重筛选机制:一是ABO血型系统中的AB型占比仅约7%-10%(中国地区更低)[[4][13]],二是Rh阴性血型在中国人群中的比例仅0.3%[[5][13]]。当两者叠加时,例如AB型Rh阴性血型的概率可低至万分之一,其珍稀程度堪比国宝大熊猫。
这种叠加的遗传机制进一步加深了其特殊性。AB型血的基因型为IAIB,需父母分别携带A和B基因;而Rh阴性血的基因型为dd,父母需均为隐性基因携带者[[4][13]]。若一个家族中同时满足这两种条件,后代成为“AB型熊猫血”的概率将微乎其微。例如网页5中提到的五兄妹案例,仅一人为Rh阴性B型,尚未出现AB型与Rh阴性的双重稀有组合。
二、临床意义的双重挑战:输血与妊娠的生死博弈

AB型Rh阴性血型在临床上面临双重矛盾。一方面,AB型血因同时携带A、B抗原,理论上可接受任何ABO血型的红细胞输注[[4][52]];但Rh阴性血型若输入Rh阳性血液,首次虽无反应,却会触发抗体生成,二次输血将引发致命溶血[[4][13]]。这种“兼容与排斥并存”的特性,使得AB型熊猫血患者在紧急用血时陷入困境——若缺乏同型血源,医生不得不在“立即救命”与“未来风险”间抉择。
对于女性而言,AB型熊猫血带来的挑战更甚。首胎若为Rh阳性胎儿,母体可能通过胎盘接触D抗原产生抗体,导致二胎出现严重溶血反应。网页4提到的抗D免疫球蛋白注射和自体储血方案,为这类人群提供了解决方案,但中国目前尚未全面普及此类医疗资源[[4][5]]。例如某案例中,母亲因未及时注射抗体阻断剂,二胎新生儿需进行全身换血治疗,医疗费用高达数十万元。
三、社会网络的互助模式:从个体到群体的生命联盟
面对稀有血型资源短缺,全球逐渐形成“自救+互助”的双轨模式。中国多地建立的“稀有血型之家”微信群,通过实时共享需求信息实现精准救援。例如2023年某地车祸患者急需AB型Rh阴性血,当地血库通过社群在4小时内召集到3名志愿者,成功采集1200毫升血液。这种模式打破了传统血站被动等待献血的局限,形成动态应急网络。
冷冻保存技术为长期保障提供新思路。日本已实现稀有血型红细胞冷冻保存10年以上,复苏后存活率达90%。中国部分三甲医院开始试点“自体血银行”,鼓励患者在健康时预存血液,需用时解冻回输[[4][13]]。例如某AB型熊猫血患者在胃癌手术前分三次储存800毫升自体血,成功避免术中异体输血风险。
四、基因研究的未来方向:从稀缺到可控的突破
基因编辑技术为人工合成“熊猫血”带来曙光。2024年,美国团队利用CRISPR技术敲除造血干细胞中的RhD基因,成功将Rh阳性血转化为Rh阴性。尽管该技术尚未进入临床,但为彻底解决血型稀缺问题提供理论路径。与此干细胞定向分化研究使得实验室培育红细胞成为可能,日本已有团队实现AB型Rh阴性红细胞的规模化培养。
与安全争议随之而来。人工改造血型是否会导致未知免疫反应?合成血液的成本如何控制?这些问题仍需跨学科协作。正如世界卫生组织在《2030全球血液安全规划》中强调:“科技突破必须与普惠性并重,避免稀有血型救治成为富人的特权。”
珍稀背后的生命启示
AB型熊猫血的特殊性,既是基因随机性的偶然产物,也折射出人类应对生命挑战的智慧。从社群互助到科技攻坚,每一次突破都在重塑我们对“稀有”的认知——它不应是命运的桎梏,而应成为推动医疗进步的契机。未来研究需聚焦三大方向:完善全国性稀有血型数据库、推进基因编辑技术的临床转化、加强公众对血型科学的认知。唯有如此,才能让每个“熊猫血”个体不再是孤岛,而是串联起人类共同生命网络的关键节点。
















